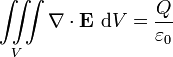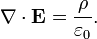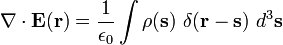با سلام.به وبلاگ من خوش آمدید امید وارم مطالب این وبلاگ به برای شما جالب باشد.
جدول عناصر شیمیایی بر اساس عدد اتمی است . رنگها بر اساس نوع عنصر طبقهبندی شدهاند . در این جدول همچنین شماره گروه و دوره ، جرم اتمی ، چگالی ، ایزوتوپ ، فراوانی ،الکترونگاتیویته ، دمای جوش و دمای ذوب آورده شده است . این فهرست مرجعی جزئی و سریع برای عناصر محسوب میگردد ؛ لذا برای کسب اطلاعات بیشتر منابع تاییدشده آیوپاک را مطالعه فرمایید .
محتویات
[نهفتن]
کلید[ویرایش]
توضیحات بیشتر[ویرایش]
- اعداد ارائهشده در بخش چگالی ، در شرایط متعارفی فشار و دما گزارش شده است .
- اطلاعات ارائهشده در مقالات عناصر در ویکیپدیا باید با اطلاعات این جدول همخوانی داشته باشد .
طبقهبندی بر اساس نوع عنصر به تفکیک رنگ[ویرایش]
| فلزات | شبهفلزها | نافلزها | نامعلوم | |||||||
| فلزات قلیایی | فلزات قلیایی خاکی | فلزات واسطه درونی | فلزات واسطه | دیگر فلزات | دیگر نافلزات | هالوژنها | گازهای نجیب | |||
| لانتانیدها | اکتینیدها | |||||||||
راهنمای عنوان ستونها[ویرایش]
Z همان عدد اتمی ، Sym همان نشان شیمیایی ، Name همان نام عنصر ، Grp همان گروههای جدول تناوبی ، Prd همان دوره (شیمی)، Weight همان جرم اتمی ، Density همان چگالی (گرم بر سانتیمتر مربع)، Melt همان دمای ذوب با واحد کلوین ، Boil همان نقطه جوش با واحد کلوین ، Heat همان ظرفیت گرمایی با واحد (ژول بر گرم کلوین) ، Neg همان الکترونگاتیوی و Abund همان فراوانی عنصر در زمین با واحد ppm وزنی است .
فهرست[ویرایش]
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
|---|---|---|---|---|---|---|---|---|---|---|---|
| ۱ | H | هیدروژن | ۱ | ۱ | ۱٫۰۰۷۹۴(۷)۲ ۳ ۴ | ۰٫۰۰۰۰۸۹۸۸ | ۱۴٫۱۷۵ | ۲۰٫۲۸ | ۱۴٫۳۰۴ | ۲٫۲۰ | ۱۴۰۰ |
| ۲ | He | هلیم | ۱۸ | ۱ | ۴٫۰۰۲۶۰۲(۲)۲ ۴ | ۰٫۰۰۰۱۷۸۵ | n/a۶ | ۴٫۲۲ | ۵٫۱۹۳ | - | ۰٫۰۰۸ |
| ۳ | Li | لیتیم | ۱ | ۲ | ۶٫۹۴۱(۲)الگو:Refef | ۰٫۵۳۴ | ۴۵۳٫۸۵ | ۱۶۱۵ | ۳٫۵۸۲ | ۰٫۹۸ | ۲۰ |
| ۴ | Be | بریلیوم | ۲ | ۲ | ۹٫۰۱۲۱۸۲(۳) | ۱٫۸۵ | ۱۵۶۰٫۱۵ | ۲۷۴۲ | ۱٫۸۲۵ | ۱٫۵۷ | ۲٫۸ |
| ۵ | B | بور | ۱۳ | ۲ | ۱۰٫۸۱۱(۷)۲ ۳ ۴ | ۲٫۳۴ | ۲۵۷۳٫۱۵ | ۴۲۰۰ | ۱٫۰۲۶ | ۲٫۰۴ | ۱۰ |
| ۶ | C | کربن | ۱۴ | ۲ | ۱۲٫۰۱۰۷(۸)۲ ۴ | ۲٫۲۶۷ | ۳۹۴۸٫۱۵۷ | ۴۳۰۰ | ۰٫۷۰۹ | ۲٫۵۵ | ۲۰۰ |
| ۷ | N | نیتروژن | ۱۵ | ۲ | ۱۴٫۰۰۶۷(۲)۲ ۴ | ۰٫۰۰۱۲۵۰۶ | ۶۳٫۲۹ | ۷۷٫۳۶ | ۱٫۰۴ | ۳٫۰۴ | ۱۹ |
| ۸ | O | اکسیژن | ۱۶ | ۲ | ۱۵٫۹۹۹۴(۳)۲ ۴ | ۰٫۰۰۱۴۲۹ | ۵۰٫۵ | ۹۰٫۲۰ | ۰٫۹۱۸ | ۳٫۴۴ | ۴۶۱۰۰۰ |
| ۹ | F | فلوئور | ۱۷ | ۲ | ۱۸٫۹۹۸۴۰۳۲(۵) | ۰٫۰۰۱۶۹۶ | ۵۳٫۶۳ | ۸۵٫۰۳ | ۰٫۸۲۴ | ۳٫۹۸ | ۵۸۵ |
| ۱۰ | Ne | نئون | ۱۸ | ۲ | ۲۰٫۱۷۹۷(۶)۲ ۳ | ۰٫۰۰۰۸۹۹۹ | ۲۴٫۷۰۳ | ۲۷٫۰۷ | ۱٫۰۳ | - | ۰٫۰۰۵ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۱۱ | Na | سدیم | ۱ | ۳ | ۲۲٫۹۸۹۷۶۹۲۸(۲) | ۰٫۹۷۱ | ۳۷۱٫۱۵ | ۱۱۵۶ | ۱٫۲۲۸ | ۰٫۹۳ | ۲۳۶۰۰ |
| ۱۲ | Mg | منیزیم | ۲ | ۳ | ۲۴٫۳۰۵۰(۶) | ۱٫۷۳۸ | ۹۲۳٫۱۵ | ۱۳۶۳ | ۱٫۰۲۳ | ۱٫۳۱ | ۲۳۳۰۰ |
| ۱۳ | Al | آلومینیم | ۱۳ | ۳ | ۲۶٫۹۸۱۵۳۸۶(۸) | ۲٫۶۹۸ | ۹۳۳٫۴ | ۲۷۹۲ | ۰٫۸۹۷ | ۱٫۶۱ | ۸۲۳۰۰ |
| ۱۴ | Si | سیلیسیم | ۱۴ | ۳ | ۲۸٫۰۸۵۵(۳)۴ | ۲٫۳۲۹۶ | ۱۶۸۳٫۱۵ | ۳۵۳۸ | ۰٫۷۰۵ | ۱٫۹ | ۲۸۲۰۰۰ |
| ۱۵ | P | فسفر | ۱۵ | ۳ | ۳۰٫۹۷۳۷۶۲(۲) | ۱٫۸۲ | ۳۱۷٫۲۵ | ۵۵۳ | ۰٫۷۶۹ | ۲٫۱۹ | ۱۰۵۰ |
| ۱۶ | S | گوگرد | ۱۶ | ۳ | ۳۲٫۰۶۵(۵)۲ ۴ | ۲٫۰۶۷ | ۳۸۸٫۵۱ | ۷۱۷٫۸ | ۰٫۷۱ | ۲٫۵۸ | ۳۵۰ |
| ۱۷ | Cl | کلر | ۱۷ | ۳ | ۳۵٫۴۵۳(۲)۲ ۳ ۴ | ۰٫۰۰۳۲۱۴ | ۱۷۲٫۳۱ | ۲۳۹٫۱۱ | ۰٫۴۷۹ | ۳٫۱۶ | ۱۴۵ |
| ۱۸ | Ar | آرگون | ۱۸ | ۳ | ۳۹٫۹۴۸(۱)۲ ۴ | ۰٫۰۰۱۷۸۳۷ | ۸۳٫۹۶ | ۸۷٫۳۰ | ۰٫۵۲ | - | ۳٫۵ |
| ۱۹ | K | پتاسیم | ۱ | ۴ | ۳۹٫۰۹۸۳(۱) | ۰٫۸۶۲ | ۳۳۶٫۵ | ۱۰۳۲ | ۰٫۷۵۷ | ۰٫۸۲ | ۲۰۹۰۰ |
| ۲۰ | Ca | کلسیم | ۲ | ۴ | ۴۰٫۰۷۸(۴)۲ | ۱٫۵۴ | ۱۱۱۲٫۱۵ | ۱۷۵۷ | ۰٫۶۴۷ | ۱ | ۴۱۵۰۰ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۲۱ | Sc | اسکاندیم | ۳ | ۴ | ۴۴٫۹۵۵۹۱۲(۶) | ۲٫۹۸۹ | ۱۸۱۲٫۱۵ | ۳۱۰۹ | ۰٫۵۶۸ | ۱٫۳۶ | ۲۲ |
| ۲۲ | Ti | تیتانیم | ۴ | ۴ | ۴۷٫۸۶۷(۱) | ۴٫۵۴ | ۱۹۳۳٫۱۵ | ۳۵۶۰ | ۰٫۵۲۳ | ۱٫۵۴ | ۵۶۵۰ |
| ۲۳ | V | وانادیم | ۵ | ۴ | ۵۰٫۹۴۱۵(۱) | ۶٫۱۱ | ۲۱۷۵٫۱۵ | ۳۶۸۰ | ۰٫۴۸۹ | ۱٫۶۳ | ۱۲۰ |
| ۲۴ | Cr | کروم | ۶ | ۴ | ۵۱٫۹۹۶۱(۶) | ۷٫۱۵ | ۲۱۳۰٫۱۵ | ۲۹۴۴ | ۰٫۴۴۹ | ۱٫۶۶ | ۱۰۲ |
| ۲۵ | Mn | منگنز | ۷ | ۴ | ۵۴٫۹۳۸۰۴۵(۵) | ۷٫۴۴ | ۱۵۱۹٫۱۵ | ۲۳۳۴ | ۰٫۴۷۹ | ۱٫۵۵ | ۹۵۰ |
| ۲۶ | Fe | آهن | ۸ | ۴ | ۵۵٫۸۴۵(۲) | ۷٫۸۷۴ | ۱۸۰۸٫۱۵ | ۳۱۳۴ | ۰٫۴۴۹ | ۱٫۸۳ | ۵۶۳۰۰ |
| ۲۷ | Co | کبالت | ۹ | ۴ | ۵۸٫۹۳۳۱۹۵(۵) | ۸٫۸۶ | ۱۷۶۸٫۱۵ | ۳۲۰۰ | ۰٫۴۲۱ | ۱٫۸۸ | ۲۵ |
| ۲۸ | Ni | نیکل | ۱۰ | ۴ | ۵۸٫۶۹۳۴(۴) | ۸٫۹۱۲ | ۱۷۲۶٫۱۵ | ۳۱۸۶ | ۰٫۴۴۴ | ۱٫۹۱ | ۸۴ |
| ۲۹ | Cu | مس | ۱۱ | ۴ | ۶۳٫۵۴۶(۳)۴ | ۸٫۹۶ | ۱۳۵۷٫۷۵ | ۲۸۳۵ | ۰٫۳۸۵ | ۱٫۹ | ۶۰ |
| ۳۰ | Zn | روی | ۱۲ | ۴ | ۶۵٫۳۸(۲) | ۷٫۱۳۴ | ۶۹۲٫۸۸ | ۱۱۸۰ | ۰٫۳۸۸ | ۱٫۶۵ | ۷۰ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۳۱ | Ga | گالیم | ۱۳ | ۴ | ۶۹٫۷۲۳(۱) | ۵٫۹۰۷ | ۳۰۲٫۹۱ | ۲۴۷۷ | ۰٫۳۷۱ | ۱٫۸۱ | ۱۹ |
| ۳۲ | Ge | ژرمانیم | ۱۴ | ۴ | ۷۲٫۶۴(۱) | ۵٫۳۲۳ | ۱۲۱۱٫۴۵ | ۳۱۰۶ | ۰٫۳۲ | ۲٫۰۱ | ۱٫۵ |
| ۳۳ | As | آرسنیک | ۱۵ | ۴ | ۷۴٫۹۲۱۶۰(۲) | ۵٫۷۷۶ | ۱۰۹۰٫۱۵۷ | ۸۸۷ | ۰٫۳۲۹ | ۲٫۱۸ | ۱٫۸ |
| ۳۴ | Se | سلنیم | ۱۶ | ۴ | ۷۸٫۹۶(۳)۴ | ۴٫۸۰۹ | ۴۹۴٫۱۵ | ۹۵۸ | ۰٫۳۲۱ | ۲٫۵۵ | ۰٫۰۵ |
| ۳۵ | Br | برم | ۱۷ | ۴ | ۷۹٫۹۰۴(۱) | ۳٫۱۲۲ | ۲۶۶٫۰۵ | ۳۳۲٫۰ | ۰٫۴۷۴ | ۲٫۹۶ | ۲٫۴ |
| ۳۶ | Kr | کریپتون | ۱۸ | ۴ | ۸۳٫۷۹۸(۲)۲ ۳ | ۰٫۰۰۳۷۳۳ | ۱۱۵٫۹۳ | ۱۱۹٫۹۳ | ۰٫۲۴۸ | ۳ | <۰٫۰۰۱ |
| ۳۷ | Rb | روبیدیم | ۱ | ۵ | ۸۵٫۴۶۷۸(۳)۲ | ۱٫۵۳۲ | ۳۱۲٫۷۹ | ۹۶۱ | ۰٫۳۶۳ | ۰٫۸۲ | ۹۰ |
| ۳۸ | Sr | استرانسیم | ۲ | ۵ | ۸۷٫۶۲(۱)۲ ۴ | ۲٫۶۴ | ۱۰۴۲٫۱۵ | ۱۶۵۵ | ۰٫۳۰۱ | ۰٫۹۵ | ۳۷۰ |
| ۳۹ | Y | ایتریم | ۳ | ۵ | ۸۸٫۹۰۵۸۵(۲) | ۴٫۴۶۹ | ۱۷۹۹٫۱۵ | ۳۶۰۹ | ۰٫۲۹۸ | ۱٫۲۲ | ۳۳ |
| ۴۰ | Zr | زیرکونیم | ۴ | ۵ | ۹۱٫۲۲۴(۲)۲ | ۶٫۵۰۶ | ۲۱۲۵٫۱۵ | ۴۶۸۲ | ۰٫۲۷۸ | ۱٫۳۳ | ۱۶۵ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۴۱ | Nb | نیوبیم | ۵ | ۵ | ۹۲٫۹۰۶۳۸(۲) | ۸٫۵۷ | ۲۷۴۱٫۱۵ | ۵۰۱۷ | ۰٫۲۶۵ | ۱٫۶ | ۲۰ |
| ۴۲ | Mo | مولیبدن | ۶ | ۵ | ۹۵٫۹۶(۲)۲ | ۱۰٫۲۲ | ۲۸۹۰٫۱۵ | ۴۹۱۲ | ۰٫۲۵۱ | ۲٫۱۶ | ۱٫۲ |
| ۴۳ | Tc | تکنسیم | ۷ | ۵ | [۹۸]۱ | ۱۱٫۵ | ۲۴۷۳٫۱۵ | ۵۱۵۰ | - | ۱٫۹ | <۰٫۰۰۱ |
| ۴۴ | Ru | روتنیم | ۸ | ۵ | ۱۰۱٫۰۷(۲)۲ | ۱۲٫۳۷ | ۲۵۲۳٫۱۵ | ۴۴۲۳ | ۰٫۲۳۸ | ۲٫۲ | ۰٫۰۰۱ |
| ۴۵ | Rh | رودیم | ۹ | ۵ | ۱۰۲٫۹۰۵۵۰(۲) | ۱۲٫۴۱ | ۲۲۳۹٫۱۵ | ۳۹۶۸ | ۰٫۲۴۳ | ۲٫۲۸ | ۰٫۰۰۱ |
| ۴۶ | Pd | پالادیم | ۱۰ | ۵ | ۱۰۶٫۴۲(۱)۲ | ۱۲٫۰۲ | ۱۸۲۵٫۱۵ | ۳۲۳۶ | ۰٫۲۴۴ | ۲٫۲ | ۰٫۰۱۵ |
| ۴۷ | Ag | نقره | ۱۱ | ۵ | ۱۰۷٫۸۶۸۲(۲)۲ | ۱۰٫۵۰۱ | ۱۲۳۴٫۱۵ | ۲۴۳۵ | ۰٫۲۳۵ | ۱٫۹۳ | ۰٫۰۷۵ |
| ۴۸ | Cd | کادمیم | ۱۲ | ۵ | ۱۱۲٫۴۱۱(۸)۲ | ۸٫۶۹ | ۵۹۴٫۳۳ | ۱۰۴۰ | ۰٫۲۳۲ | ۱٫۶۹ | ۰٫۱۵۹ |
| ۴۹ | In | ایندیم | ۱۳ | ۵ | ۱۱۴٫۸۱۸(۳) | ۷٫۳۱ | ۴۲۹٫۹۱ | ۲۳۴۵ | ۰٫۲۳۳ | ۱٫۷۸ | ۰٫۲۵ |
| ۵۰ | Sn | قلع | ۱۴ | ۵ | ۱۱۸٫۷۱۰(۷)۲ | ۷٫۲۸۷ | ۵۰۵٫۲۱ | ۲۸۷۵ | ۰٫۲۲۸ | ۱٫۹۶ | ۲٫۳ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۵۱ | Sb | آنتیموان | ۱۵ | ۵ | ۱۲۱٫۷۶۰(۱)۲ | ۶٫۶۸۵ | ۹۰۴٫۰۵ | ۱۸۶۰ | ۰٫۲۰۷ | ۲٫۰۵ | ۰٫۲ |
| ۵۲ | Te | تلوریم | ۱۶ | ۵ | ۱۲۷٫۶۰(۳)۲ | ۶٫۲۳۲ | ۷۲۲٫۸ | ۱۲۶۱ | ۰٫۲۰۲ | ۲٫۱ | ۰٫۰۰۱ |
| ۵۳ | I | ید | ۱۷ | ۵ | ۱۲۶٫۹۰۴۴۷(۳) | ۴٫۹۳ | ۳۸۶٫۶۵ | ۴۵۷٫۴ | ۰٫۲۱۴ | ۲٫۶۶ | ۰٫۴۵ |
| ۵۴ | Xe | زنون | ۱۸ | ۵ | ۱۳۱٫۲۹۳(۶)۲ ۳ | ۰٫۰۰۵۸۸۷ | ۱۶۱٫۴۵ | ۱۶۵٫۰۳ | ۰٫۱۵۸ | ۲٫۶ | <۰٫۰۰۱ |
| ۵۵ | Cs | سزیم | ۱ | ۶ | ۱۳۲٫۹۰۵۴۵۱۹(۲) | ۱٫۸۷۳ | ۳۰۱٫۷ | ۹۴۴ | ۰٫۲۴۲ | ۰٫۷۹ | ۳ |
| ۵۶ | Ba | باریم | ۲ | ۶ | ۱۳۷٫۳۲۷(۷) | ۳٫۵۹۴ | ۱۰۰۲٫۱۵ | ۲۱۷۰ | ۰٫۲۰۴ | ۰٫۸۹ | ۴۲۵ |
| ۵۷ | La | لانتان | ۶ | ۱۳۸٫۹۰۵۴۷(۷)۲ | ۶٫۱۴۵ | ۱۱۹۳٫۱۵ | ۳۷۳۷ | ۰٫۱۹۵ | ۱٫۱ | ۳۹ | |
| ۵۸ | Ce | سریم | ۶ | ۱۴۰٫۱۱۶(۱)۲ | ۶٫۷۷ | ۱۰۷۱٫۱۵ | ۳۷۱۶ | ۰٫۱۹۲ | ۱٫۱۲ | ۶۶٫۵ | |
| ۵۹ | Pr | پرازئودیمیم | ۶ | ۱۴۰٫۹۰۷۶۵(۲) | ۶٫۷۷۳ | ۱۲۰۴٫۱۵ | ۳۷۹۳ | ۰٫۱۹۳ | ۱٫۱۳ | ۹٫۲ | |
| ۶۰ | Nd | نئودیمیم | ۶ | ۱۴۴٫۲۴۲(۳)۲ | ۷٫۰۰۷ | ۱۲۸۹٫۱۵ | ۳۳۴۷ | ۰٫۱۹ | ۱٫۱۴ | ۴۱٫۵ | |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۶۱ | Pm | پرومتیم | ۶ | [۱۴۵]۱ | ۷٫۲۶ | ۱۲۰۴٫۱۵ | ۳۲۷۳ | - | - | <۰٫۰۰۱ | |
| ۶۲ | Sm | ساماریم | ۶ | ۱۵۰٫۳۶(۲)۲ | ۷٫۵۲ | ۱۳۴۵٫۱۵ | ۲۰۶۷ | ۰٫۱۹۷ | ۱٫۱۷ | ۷٫۰۵ | |
| ۶۳ | Eu | یوروپیم | ۶ | ۱۵۱٫۹۶۴(۱)۲ | ۵٫۲۴۳ | ۱۰۹۵٫۱۵ | ۱۸۰۲ | ۰٫۱۸۲ | ۱٫۲ | ۲ | |
| ۶۴ | Gd | گادولینیم | ۶ | ۱۵۷٫۲۵(۳)۲ | ۷٫۸۹۵ | ۱۵۸۵٫۱۵ | ۳۵۴۶ | ۰٫۲۳۶ | ۱٫۲ | ۶٫۲ | |
| ۶۵ | Tb | تربیم | ۶ | ۱۵۸٫۹۲۵۳۵(۲) | ۸٫۲۲۹ | ۱۶۳۰٫۱۵ | ۳۵۰۳ | ۰٫۱۸۲ | ۱٫۲ | ۱٫۲ | |
| ۶۶ | Dy | دیسپروزیم | ۶ | ۱۶۲٫۵۰۰(۱)۲ | ۸٫۵۵ | ۱۶۸۰٫۱۵ | ۲۸۴۰ | ۰٫۱۷ | ۱٫۲۲ | ۵٫۲ | |
| ۶۷ | Ho | هولمیم | ۶ | ۱۶۴٫۹۳۰۳۲(۲) | ۸٫۷۹۵ | ۱۷۴۳٫۱۵ | ۲۹۹۳ | ۰٫۱۶۵ | ۱٫۲۳ | ۱٫۳ | |
| ۶۸ | Er | اربیم | ۶ | ۱۶۷٫۲۵۹(۳)۲ | ۹٫۰۶۶ | ۱۷۹۵٫۱۵ | ۳۵۰۳ | ۰٫۱۶۸ | ۱٫۲۴ | ۳٫۵ | |
| ۶۹ | Tm | تولیم | ۶ | ۱۶۸٫۹۳۴۲۱(۲) | ۹٫۳۲۱ | ۱۸۱۸٫۱۵ | ۲۲۲۳ | ۰٫۱۶ | ۱٫۲۵ | ۰٫۵۲ | |
| ۷۰ | Yb | ایتربیم | ۶ | ۱۷۳٫۰۵۴(۵)۲ | ۶٫۹۶۵ | ۱۰۹۷٫۱۵ | ۱۴۶۹ | ۰٫۱۵۵ | ۱٫۱ | ۳٫۲ | |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۷۱ | Lu | لوتتیم | ۳ | ۶ | ۱۷۴٫۹۶۶۸(۱)۲ | ۹٫۸۴ | ۱۹۳۶٫۱۵ | ۳۶۷۵ | ۰٫۱۵۴ | ۱٫۲۷ | ۰٫۸ |
| ۷۲ | Hf | هافنیم | ۴ | ۶ | ۱۷۸٫۴۹(۲) | ۱۳٫۳۱ | ۲۵۰۰٫۱۵ | ۴۸۷۶ | ۰٫۱۴۴ | ۱٫۳ | ۳ |
| ۷۳ | Ta | تانتال | ۵ | ۶ | ۱۸۰٫۹۴۷۸۸(۲) | ۱۶٫۶۵۴ | ۳۲۶۹٫۱۵ | ۵۷۳۱ | ۰٫۱۴ | ۱٫۵ | ۲ |
| ۷۴ | W | تنگستن | ۶ | ۶ | ۱۸۳٫۸۴(۱) | ۱۹٫۲۵ | ۳۶۸۰٫۱۵ | ۵۸۲۸ | ۰٫۱۳۲ | ۲٫۳۶ | ۱٫۳ |
| ۷۵ | Re | رنیوم | ۷ | ۶ | ۱۸۶٫۲۰۷(۱) | ۲۱٫۰۲ | ۳۴۵۳٫۱۵ | ۵۸۶۹ | ۰٫۱۳۷ | ۱٫۹ | <۰٫۰۰۱ |
| ۷۶ | Os | اسمیم | ۸ | ۶ | ۱۹۰٫۲۳(۳)۲ | ۲۲٫۶۱ | ۳۳۰۰٫۱۵ | ۵۲۸۵ | ۰٫۱۳ | ۲٫۲ | ۰٫۰۰۲ |
| ۷۷ | Ir | ایریدیم | ۹ | ۶ | ۱۹۲٫۲۱۷(۳) | ۲۲٫۵۶ | ۲۷۱۶٫۱۵ | ۴۷۰۱ | ۰٫۱۳۱ | ۲٫۲ | ۰٫۰۰۱ |
| ۷۸ | Pt | پلاتین | ۱۰ | ۶ | ۱۹۵٫۰۸۴(۹) | ۲۱٫۴۶ | ۲۰۴۵٫۱۵ | ۴۰۹۸ | ۰٫۱۳۳ | ۲٫۲۸ | ۰٫۰۰۵ |
| ۷۹ | Au | طلا | ۱۱ | ۶ | ۱۹۶٫۹۶۶۵۶۹(۴) | ۱۹٫۲۸۲ | ۱۳۳۷٫۷۳ | ۳۱۲۹ | ۰٫۱۲۹ | ۲٫۵۴ | ۰٫۰۰۴ |
| ۸۰ | Hg | جیوه | ۱۲ | ۶ | ۲۰۰٫۵۹(۲) | ۱۳٫۵۳۳۶ | ۲۳۴٫۴۳ | ۶۳۰ | ۰٫۱۴ | ۲ | ۰٫۰۸۵ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۸۱ | Tl | تالیم | ۱۳ | ۶ | ۲۰۴٫۳۸۳۳(۲) | ۱۱٫۸۵ | ۵۷۷٫۱۵ | ۱۷۴۶ | ۰٫۱۲۹ | ۱٫۶۲ | ۰٫۸۵ |
| ۸۲ | Pb | سرب | ۱۴ | ۶ | ۲۰۷٫۲(۱)۲ ۴ | ۱۱٫۳۴۲ | ۶۰۰٫۷۵ | ۲۰۲۲ | ۰٫۱۲۹ | ۲٫۳۳ | ۱۴ |
| ۸۳ | Bi | بیسموت | ۱۵ | ۶ | ۲۰۸٫۹۸۰۴۰(۱) | ۹٫۸۰۷ | ۵۴۴٫۶۷ | ۱۸۳۷ | ۰٫۱۲۲ | ۲٫۰۲ | ۰٫۰۰۹ |
| ۸۴ | Po | پولونیم | ۱۶ | ۶ | [۲۱۰]۱ | ۹٫۳۲ | ۵۲۷٫۱۵ | ۱۲۳۵ | - | ۲ | <۰٫۰۰۱ |
| ۸۵ | At | استاتین | ۱۷ | ۶ | [۲۱۰]۱ | ۷ | ۵۷۵٫۱۵ | ۶۱۰ | - | ۲٫۲ | <۰٫۰۰۱ |
| ۸۶ | Rn | رادون | ۱۸ | ۶ | [۲۲۲]۱ | ۰٫۰۰۹۷۳ | ۲۰۲٫۱۵ | ۲۱۱٫۳ | ۰٫۰۹۴ | - | <۰٫۰۰۱ |
| ۸۷ | Fr | فرانسیم | ۱ | ۷ | [۲۲۳]۱ | ۱٫۸۷ | ۳۰۰٫۱۵ | ۹۵۰ | - | ۰٫۷ | <۰٫۰۰۱ |
| ۸۸ | Ra | رادیم | ۲ | ۷ | [۲۲۶]۱ | ۵٫۵ | ۹۷۳٫۱۵ | ۲۰۱۰ | - | ۰٫۹ | <۰٫۰۰۱ |
| ۸۹ | Ac | اکتینیم | ۷ | [۲۲۷]۱ | ۱۰٫۰۷ | ۱۳۲۳٫۱۵ | ۳۴۷۱ | ۰٫۱۲ | ۱٫۱ | <۰٫۰۰۱ | |
| ۹۰ | Th | توریم | ۷ | ۲۳۲٫۰۳۸۰۶(۲)۱ ۲ | ۱۱٫۷۲ | ۲۰۲۸٫۱۵ | ۵۰۶۱ | ۰٫۱۱۳ | ۱٫۳ | ۹٫۶ | |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۹۱ | Pa | پروتاکتینیم | ۷ | ۲۳۱٫۰۳۵۸۸(۲)۱ | ۱۵٫۳۷ | ۱۸۷۳٫۱۵ | ۴۳۰۰ | - | ۱٫۵ | <۰٫۰۰۱ | |
| ۹۲ | U | اورانیوم | ۷ | ۲۳۸٫۰۲۸۹۱(۳)۱ | ۱۸٫۹۵ | ۱۴۰۵٫۱۵ | ۴۴۰۴ | ۰٫۱۱۶ | ۱٫۳۸ | ۲٫۷ | |
| ۹۳ | Np | نپتونیوم | ۷ | [۲۳۷]۱ | ۲۰٫۴۵ | ۹۱۳٫۱۵ | ۴۲۷۳ | - | ۱٫۳۶ | <۰٫۰۰۱ | |
| ۹۴ | Pu | پلوتونیم | ۷ | [۲۴۴]۱ | ۱۹٫۸۴ | ۹۱۳٫۱۵ | ۳۵۰۱ | - | ۱٫۲۸ | <۰٫۰۰۱ | |
| ۹۵ | Am | امریسیم | ۷ | [۲۴۳]۱ | ۱۳٫۶۹ | ۱۲۶۷٫۱۵ | ۲۸۸۰ | - | ۱٫۳ | ۰۸ | |
| ۹۶ | Cm | کوریم | ۷ | [۲۴۷]۱ | ۱۳٫۵۱ | ۱۳۴۰٫۱۵ | ۳۳۸۳ | - | ۱٫۳ | ۰ | |
| ۹۷ | Bk | برکلیم | ۷ | [۲۴۷]۱ | ۱۴٫۷۹ | ۱۲۵۹٫۱۵ | ۹۸۳ | - | ۱٫۳ | ۰ | |
| ۹۸ | Cf | کالیفرنیم | ۷ | [۲۵۱]۱ | ۱۵٫۱ | ۱۹۲۵٫۱۵ | ۱۱۷۳ | - | ۱٫۳ | ۰ | |
| ۹۹ | Es | اینشتینیم | ۷ | [۲۵۲]۱ | ۱۳٫۵ | ۱۱۳۳٫۱۵ | - | - | ۱٫۳ | ۰ | |
| ۱۰۰ | Fm | فرمیم | ۷ | [۲۵۷]۱ | - | - | - | - | ۱٫۳ | ۰ | |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۱۰۱ | Md | مندلیفیم | ۷ | [۲۵۸]۱ | - | - | - | - | ۱٫۳ | ۰ | |
| ۱۰۲ | No | نوبلیم | ۷ | [۲۵۹]۱ | - | - | - | - | ۱٫۳ | ۰ | |
| ۱۰۳ | Lr | لارنسیم | ۳ | ۷ | [۲۶۲]۱ | - | - | - | - | ۱٫۳ | ۰ |
| ۱۰۴ | Rf | رادرفوردیم | ۴ | ۷ | [۲۶۱]۱ | ۱۸٫۱ | - | - | - | - | ۰ |
| ۱۰۵ | Db | دوبنیم | ۵ | ۷ | [۲۶۲]۱ | ۳۹ | - | - | - | - | ۰ |
| ۱۰۶ | Sg | سیبورگیم | ۶ | ۷ | [۲۶۶]۱ | ۳۵ | - | - | - | - | ۰ |
| ۱۰۷ | Bh | بوریم | ۷ | ۷ | [۲۶۴]۱ | ۳۷ | - | - | - | - | ۰ |
| ۱۰۸ | Hs | هاسیم | ۸ | ۷ | [۲۶۷]۱ | ۴۱ | - | - | - | - | ۰ |
| ۱۰۹ | Mt | مایتنریم | ۹ | ۷ | [۲۶۸]۱ | ۳۵ | - | - | - | - | ۰ |
| ۱۱۰ | Ds | دارمشتادیم | ۱۰ | ۷ | [۲۷۱]۱ | - | - | - | - | - | ۰ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۱۱۱ | Rg | رونتگنیوم | ۱۱ | ۷ | [۲۷۲]۱ | - | - | - | - | - | ۰ |
| ۱۱۲ | Cn | کوپرنیسیم | ۱۲ | ۷ | [۲۸۵]۱ | - | - | - | - | - | ۰ |
| ۱۱۳ | Uut | آنانتریوم | ۱۳ | ۷ | [۲۸۴]۱ | - | - | - | - | - | ۰ |
| ۱۱۴ | Uuq | آنانکادیوم | ۱۴ | ۷ | [۲۸۹]۱ | - | - | - | - | - | ۰ |
| ۱۱۵ | Uup | آنانپنتیوم | ۱۵ | ۷ | [۲۸۸]۱ | - | - | - | - | - | ۰ |
| ۱۱۶ | Uuh | آنانهگزیوم | ۱۶ | ۷ | [۲۹۲]۱ | - | - | - | - | - | ۰ |
| ۱۱۷ | Uus | آنانسپتیوم | ۱۷ | ۷ | [۲۹۵]۱ | - | - | - | - | - | ۰ |
| ۱۱۸ | Uuo | آناناکتیوم | ۱۸ | ۷ | [۲۹۴]۱ | - | - | - | - | - | ۰ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
.
جستارهای وابسته[ویرایش]
چند ضلعی ها
چند ضلعيها
تعريف چند ضلعي :
هر خط شكسته بسته را چند ضلعي مي نامند . مثلث يك چند ضلعي (سه ضلعي) است. اگر يكي از زواياي داخلي چند ضلعي بزرگتراز 180 درجه باشد،چند ضلعي را مقعر و در غير اين صورت چند ضلعي را محدب مي نامند.
نكته 1 :
مجموع اندازه هاي زواياي هر n ضلعي برابر با درجه است.
براي مثال ، مجموع اندازه هاي زواياي يك هفت ضلعي برابر با درجه است.
نكته 2 :
تعداد قطرهاي هر n ضلعي محدب برابر با
½ (n)(n-3)
است.
نكته 3 :
در چند ضلعيهاي منتظم با تعداداضلاع زوج، اضلاع مقابل بر هم ، با هم موازيند.
نكته 4 :
در هر چند ضلعي منتظم با تعداد اضلاع فرد، عمودمنصف هر ضلع ، نيمساز زاويه مقابل به آن ضلع است. كه اين عمود منصف (يا نيمساز) محور تقارن آن چند ضلعي است.
متوازي الاضلاع
چهار ضلعي است كه هر دو ضلع آن موازي باشند. در متوازي الاضلاع، فاصله هر دو ضلع مقابل به هم را ارتفاع مي نامند.
ويژگيهاي متوازي الاضلاع
الف) در هر متوازي الاضلاع، اضلاع مقابل با هم برابر هستند.
ب)درهر متوازي الاضلاع زاويه هاي مقابل برابرند و هر دو زاويه مجاور يك ضلع مكمل يكديگرند. همچنين مجموع دو زاويه مجاور برابر 180 درجه است.
ج) در هر متوازي الاضلاع قطرها منصف يكديگرند.
د) در هر متوازي الاضلاع نقطه تقاطع دو قطر مركز تقارن آن شكل است.
ه) مساحت متوازي الاضلاع برابر با حاصلضرب قاعده در ارتفاع وارد بر آن است.
ز) در هر متوازي الاضلاع، نيمسازهاي داخلي دو به دو بر هم عمودند.
لوزي
لوزي متوازي الاضلاعي است كه چهار ضلع آن با هم برابر باشند. بنابراين لوزي كليه ويژگيهاي متوازي الاضلاع را دارد.
مساحت و محيط لوزي :
مساحت لوزي برابر نصف حاصلضرب اندازه هاي دو قطر است.
نكته 1 :
از هر لوزي يك دايره محاطي مي گذرد.
كايت
كايت يا شبه لوزي ، چهار ضلعي محدبي است كه داراي دو جفت اضلاع مجاور مساوي با دو اندازه مختلف باشد. در واقع كايت چهار ضلعي محدبي است كه داراي دو قطر عمود بر هم باشد و فقط يكي از قطرها منصف قطر ديگر باشد. قطري كه منصف قطر ديگر است، محور تقارن كايت و همچنين نيمساز دو زاويه مقابل است. مساحت كايت مانند مساحت لوزي محاسبه مي شود.
مستطيل
مستطيل متوازي الاضلاعي است كه يك زاويه آن قائمه باشد. بنابراين مستطيل كليه ويژگيهاي متوازي الاضلاع را داراست. خطي كه وسط دو ضلع مقابل را به هم وصل كند محور تقارن مستطيل است. بنابراين مستطيل دو محور تقارن دارد.
نكته 1 :
مساحت مستطيل برابر حاصلضرب طول در عرض آن است.
نكته 2 :
بر مستطيل يك دايره محيطي مي گذرد.
مربع
مربع مستطيلي است كه چهار ضلع آن با هم مساوي باشد و يا مي توان گفت ، مربع لوزي است كه يك زاويه آن قائمه باشد. بنابراين مربع كليه ويژگيهاي متوازي الاضلاع، مستطيل و لوزي را دارد.
نكته 1 :
در هر مربع قطرها بر هم عمود و با هم برابر و هر كدام محور تقارن شكل هستند.
نكته 2 :
مربع چهار محور تقارن (به تعداد اضلاع) دارد. مربع يك چهار ضلعي منتظم است و كليد ويژگيهاي چند ضلعي منتظم را داراست.
مساحت و محيط مربع : مساحت مربع برابر مجذوب يك ضلع است.
ذوزنقه
هر چهار ضلعي كه فقط دو ضلع آن با هم موازي باشند، ذوزنقه ناميده مي شود. دو ضلع موازي را قاعده ها، و دو ضلع غيرموازي را ساقها مي نامند. اگر دو ساق ذوزنقه با هم مساوي باشند ذوزنقه را متساوي الساقين مي نامند، اگر يكي از ساقها بر دو قاعده عمود باشد ذوزنقه را قائم الزاويه مي نامند.
نكته 1 :
در هر ذوزنقه دو زاويه مجاوز بر هر ساق مكمل يكديگرند.
نكته 2 :
در هر ذوزنقه متساوي الساقين دو قطر با هم و همچنين دو زاويه مجاور به هر قاعده با هم برابر هستند.
نكته 3 :
پاره خطي كه دو سر آن وسط هاي دو ساق ذوزنقه باشد، موازي دو قاعده آن ذوزنقه و اندازه آن برابر نصف مجموع اندازه هاي دو قاعده ذوزنقه است.
مساحت ذوزنقه :
مساحت ذوزنقه با نصف حاصلضرب مجموع دو قاعده درارتفاع آن برابر است.
چهار ضلعي هاي محيطي
چهار ضلعي محيطي چهار ضلعي است كه اضلاع آن بر يك دايره مماس باشند.
نكته 1 :
درهر چهار ضلعي محيطي مجموع دو ضلع مقابل با مجموع دو ضلع مقابل ديگر برابر است.
چهارضلعي هاي محاطي
چهار ضلعي محاطي چهار ضلعي است كه رأسهاي آن بر يك دايره واقع باشد.
نكته 1 :
در هر چهار ضلعي محاطي مجموع دو زاويه مقابل 180 درجه است.
وظایف قوه قضاییه چیست؟
قوه قضاییه در قانون اساسی وظایفی از جمله استخدام قضات عادل، احیای حقوق عامه و همچنین اقدام مناسب برای پیشگیری از وقوع جرم را بر عهده دارد.
۴- کشف جرم و تعقیب مجازات و تعزیر مجرمین و اجرای حدود و مقررات مدون جزایی اسلام ۵- اقدام مناسب برای پیشگیری از وقوع جرم و اصلاح مجرمین
اصل ۱۵۷: به منظور انجام مسئولیتهای قوه قضاییه در کلیه امور قضایی و اداری و اجرایی مقام رهبری یک نفر مجتهد عادل و آگاه به امور قضایی و مدیر و مدبر را برای مدت ۵ سال به عنوان رییس قوه قضاییه تعیین میکند که عالیترین مقام قوه قضاییه است اصل ۱۵۸: وظایف رییس قوه قضاییه به شرح زیر است: ۱- ایجاد تشکیلات لازم در دادگستری به تناسب مسئولیتهای اصل یکصد و پنجاه و ششم
۲- تهیه لوایح قضایی متناسب با جمهوری اسلامی ۳- استخدام قضات عادل و شایسته و عزل و نصب آنها و تغییر محل مأموریت و تعیین مشاغل و ترفیع آنان و مانند اینها از امور اداری، طبق قانون اصل۱۵۹: مرجع رسمی تظلمات و شکایات، دادگستری است. تشکیل دادگاهها و تعیین صلاحیت آنها منوط به حکم قانون است
اصل ۱۶۰: وزیر دادگستری مسئولیت کلیه مسائل مربوطه به روابط قوه قضاییه با قوه مجریه و قوه مقننه را بر عهده دارد و از میان کسانی که رییس قوه قضاییه به رییس جمهور پیشنهاد میکند انتخاب می شود. رییس قوه قضاییه میتواند اختیارات تام مالی و اداری و نیز اختیارات استخدامی غیر قضات را به وزیر دادگستری تفویض کند. در این صورت وزیر دادگستری دارای همان اختیارات و وظایفی خواهد بود که در قوانین برای وزرا به عنوان عالیترین مقام اجرایی پیشبینی میشود. اصل ۱۶۱: دیوان عالی کشور به منظور نظارت بر اجرای صحیح قوانین در محاکم و ایجاد وحدت رویه قضایی و انجام مسئولیتهایی که طبق قانون به آن محول میشود بر اساس ضوابطی که رییس قوه قضاییه تعیین میکند تشکیل میشود. اصل ۱۶۲: رییس دیوان عالی کشور و دادستان کل باید مجتهد عادل و آگاه به امور قضایی باشند و رییس قوه قضاییه با مشورت قضایت دیوان عالی کشور آنها را برای مدت پنج سال به این سمت منصوب میکند.
اصل ۱۶۳: صفات و شرایط قاضی طبق موازین فقهی به وسیله قانون معین میشود.
اصل ۱۶۴: قاضی را نمی توان از مقامی که شاغل آن است بدون محاکمه و پبوست جرم یا تخلفی که موجب انفصال است به طور موقت یا دائم منفصل کرد یا بدون رضای او محل خدمت یا سمتش را تغییر داد مگر به اقتضای مصلحت جامعه با تصمیم رییس قوه قضاییه پس از مشورت با رییس دیوان عالی کشور و دادستان کل. نقل و انتقال دورهای قضات بر طبق ضوابط کلی است که قانون تعیین میکند صورت میگیرد. اصل ۱۶۵: محاکمات، علنی انجام میشود و حضور افراد بلامانع است مگر آن که به تشخیص دادگاه، علنی بودن آن منافی عفت عمومی یا نظم عمومی باشد یا در دعاوی خصوصی طرفین دعوا تقاضا کنند که محاکمه علنی نباشد. اصل ۱۶۶: احکام دادگاهها باید مستدل و مستند به مواد قانون و اصولی باشد که بر اساس آن حکم صادر شده است. اصل ۱۶۷: قاضی موظف است کوشش کند حکم هر دعوا را در قوانین مدونه بیابد و اگر نیابد با استناد به منابع معتبر اسلامی یا فتاوای معتبر، حکم قضیه را صادر کند و نمیتواند به بهانه سکوت یا نقص یا اجمال یا تعارض قوانین مدونه از رسیدگی به دعوا و صدور حکم امتناع ورزد.
اصل ۱۶۸: رسیدگی به جرایم سیاسی و مطبوعاتی علنی است و با حضور هیأت منصفه در محاکم دادگستری صورت میگیرد. نحوه انتخاب، شرایط، اختیارات هیأت منصفه و تعریف جرم سیاسی را قانون ر اساس موازین اسلامی معین میکند. اصل ۱۶۹: هیچ فعلی یا ترک فعلی به استناد قانونی که بعد از آن وضع شده است جرم محسوب نمیشود.
اصل ۱۷۰: قضات دادگاهها مکلفند از اجرای تصویبنامهها و آییننامههای دولتی که مخالف با قوانین و مقررات اسلامی یا خارج از حدود اختیارات قوه مجریه است خودداری کنند و هر کس میتواند ابطال این گونه مقررات را از دیوان عدالت اداری تقاضا کند. اصل ۱۷۱: هرگاه در اثر تفسیر یا اشتباه قاضی در موضوع یا در حکم یا در تطبیق حکم بر مورد خاص، ضرر مادی یا معنوی متوجه کسی گردد، در صورت تقصیر، مقصر طبق موازین اسلامی ضامن است و در غیر این صورت خسارت به وسیله دولت جبران و در هر حال از متهم اعاده حیثیت میشود. اصل ۱۷۲: آرای رسیدگی به جرایم مربوط به وظایف خاص نظامی یا انتظامی اعضاء ارتش، ژاندارمری، شهربانی و سپاه پاسداران انقلاب اسلامی، محاکم نظامی مطابق قانون تشکیل میشود، ولی به جرایم عمومی آنان یا جرایمی که در مقام ضابط دادگستری مرتکب شوند در محاکم عمومی رسیدگی میشود.
دادستانی و دادگاههای نظامی، بخشی از قوه قضاییه کشور و مشمول اصول مربوط به این قوه هستند. اصل ۱۷۳: به منظور رسیدگی به شکایات، تظلمات و اعتراضات مردم نسبت به مأمورین یا واحدها با آیین نامه های دولتی و احقاق حقوق آنها، دیوانی به نام "دیوان عدالت اداری" زیر نظر رییس قوه قضاییه تأسیس میشود، حدود اختیارات و نحوه عمل این دیوان را قانون تعیین میکند. اصل ۱۷۴: بر اساس حق نظارت قوه قضاییه نسبت به حسن جریان امور و اجرای صحیح قوانین در دستگاههای اداری سازمانی به نام "سازمان بازرسی کل کشور" زیر نظر رییس قوه قضاییه تشکیل میشود، حدود اختیارات و وظایف این سازمان را قانون تعیین میکند.
قوه مجریه یکی از قوای سهگانه است که وظیفه اداره کشور بر اساس قوانینی را کهقوه مقننه مصوب کرده دارد. رئیس قوه مجریه رئیس جمهور است.
ارکان
قوه مجریه دارای ارکان مختلفی است:
۱. وزارتخانهها مانند وزارت کشور، وزارت امور خارجه و وزارت دفاع و سازمانها و شرکتهای تابعه
۲. معاونین و مشاورین ریاست جمهوری و سازمانهای تابعه مانند سازمان مدیریت و برنامه ریزی، بانک مرکزی، سازمان حفاظت از محیط زیست، سازمان تربیت بدنی
ریاست قوه مجریه
ریاست قوه مجریه در ایران با رییس جمهور است که با رای مستقیم مردم انتخاب میشود مانند آمریکا و ... در برخی کشورها که دارای نظام پارلمانی هستند مانند هندو انگلستان ریاست قوه مجریه با نخست وزیر است که توسط نمایندگان مجلس انتخاب میشود. گاه چنین کشورهایی دارای پادشاه مانند سوئد و یا رییس جمهور مانند آلمانهستند که مقامی تشریفاتی محسوب میشود. در برخی کشورها مانند روسیه، ترکیه و پاکستان ریاست جمهور و نخست وزیر هر دو دارای قدرت هستند.
وظایف قوه مجریه
اداره، سیاستگذاری و نظارت بر امور اقتصادی کشور، آموزش و پژوهش، روابط خارجه، بهداشت و درمان، کشاورزی و صنعت، امنیت و تامین نیازهای دفاعی و تامین نیازها و ملزومات سایر قوا مانند قوه مقننه، قوه قضائیه، شورای نگهبان و ... بر عهده قوه مجریهاست.
عدد اول

عدد اول عددی طبیعی بزرگتر از ۱ است که بر هیچ عدد مثبتی بجز خود و ۱بخشپذیر نباشد. تنها استثنا عدد ۱ است که جزو این اعداد قرار نمیگیرد. اگرعددی طبیعی وبزرگتر از ۱ اول نباشد مرکب است.
رقم یکان اعداد اول بزرگتر از ۱۰ فقط ممکن است ارقام ۱، ۳، ۷، و ۹ باشد.
پیدا کردن رابطهای جبری برای اعداد اول جزو یکی از معماهای ریاضی باقیمانده است و هنوز کسی به فرمولی برای آنها دست نیافته است.
دنبالهٔ اعداد اول به این صورت شروع میشود:
۲، ۳، ۵، ۷، ۱۱، ۱۳، ۱۷، ۱۹، ۲۳، ۲۹، ۳۱، ۳۷، ۴۱، ۴۳، ۴۷، ۵۳، ۵۹، ۶۱، ۶۷،۷۱، ۷۳، ۷۹، ۸۳، ۸۹، ۹۷، ۱۰۱، ۱۰۳، ۱۰۷، ۱۰۹، ۱۱۳، ۱۲۷، ۱۳۱، ۱۳۷، ۱۳۹[۱]
محتویات
[نهفتن]
قضیهها[ویرایش]
- قضیه ۱: تعداد اعداد اول بینهایت است.
به این اثبات دقت کنیداز برهان خلف استفاده می کنیم:
فرض خلف : اعداد اول متناهی است.
اعداد اول را در هم ضرب می کنیم.
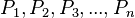
ضرب اعداد از  بزرگتراست.
بزرگتراست.






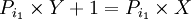
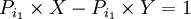
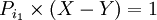
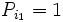
که عدد ۱ جزو اعداد اول نیست پس به تناقض می رسیم و فرض خلف باطل است. اعداد اول نامتناهی هستند.
- قضیه 2 (قضیه اساسی حساب): هر عدد طبیعی بزرگتر از ۱ را میتوان به شکل حاصلضرب اعدادی اول نوشت.
- قضیه 3 (قضیه چبیشف):اگر n عددی طبیعی و بزرگتر از ۳ باشد، حتما" بین n و ۲n عدد اولی وجود دارد.
- قضیه 4 (قضیه اردیش (تعمیم قضیه چبیشف)): برای هر عدد طبیعی k، وجود دارد یک عدد طبیعی مثل N، که برای هر n>N ،بین n و 2n،
k عدد اول وجود دارد.
قضایای اعداد اول[ویرایش]
قضیه گلدباخ (تاکنون اثبات نشده): هر عدد زوج را میتوان به شکل جمع دو عدد اول نوشت.
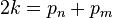
مثال:

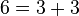
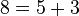

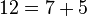

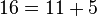
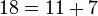
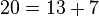
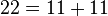

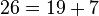
تابع شمارش اعداد اول[ویرایش]
در ریاضیات تابع شمارش اعداد اول تابعی است که برای بیان تعداد اعداد اول به کار میرود و آن را با نماد \pi(x) نمایش میدهند.
ریاضیدان فرانسوی پیر دوسارارت ثابت کرد که برای x ≥ ۵۹۹ رابطه زیر برقرار است:

همچنین ثابت کرد که برای هر x ≥ ۳۵۵۹۹۱:

بعدها ثابت شد که برای هر ε>۰ وجود دارد عددی طبیعی ماننده s که برای هر x>s رابطه زیر برقرار است:

قضیه اعداد اول (prime number theorem)[ویرایش]
اگر تعداد اعداد اول کمتر از
تعداد اعداد اول کمتر از 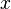 باشد
باشد
آنگاه 
-
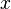


10 4 0.921 102 25 1.151 103 168 1.161 104 1,229 1.132 105 9,592 1.104 106 78,498 1.084 107 664,579 1.071 108 5,761,455 1.061 109 50,847,534 1.054 1010 455,052,511 1.048 OEIS A006880 A057835
با استفاده از قضیه اعداد اول می توان اثبات کرد که:

که در آن تابع  ، تابع مولد اعداد اول باشد. یعنی x امین عدد اول
، تابع مولد اعداد اول باشد. یعنی x امین عدد اول 
اثبات مطلب بالا به شرح زیر است:
می دانیم 

می دانیم توابع  و
و  معکوس هم هستند. یعنی:
معکوس هم هستند. یعنی:

در نتیجه می توان با حل معادله  تابع
تابع  را یافت.
را یافت.
می دانیم 
پس با حل معادله  می توان هم ارزی برای
می توان هم ارزی برای  یاقت.
یاقت.
به روش تکرار ساده معادله را حل میکنیم.
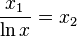


اما باید توجه داشت چون به جای  از تابع هم ارز آن استفاده شده پس:
از تابع هم ارز آن استفاده شده پس:
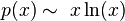
در نتیجه:

قضیه ویلسون راهی برای تشخیص اعداد اول[ویرایش]
قضیه ویلسون راهی برای تشخیص اعداد اول است. این قضیه بیان میکند به ازای هر عدد اول مانند  داریم
داریم 
این قضیه دوشرطی است بنابراین راهی برای تشخیص اعداد اول از مرکب است یعنی:
برای هر عدد صحیح x اگر رابطه زیر برقرار باشد آنگاه x عددی اول است در غیر این صورت x عددی غیر مرکب است.

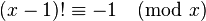
این قضیه تعمیم هایی به شکل زیر دارد:
تعمیم گاوس: کارل فریدریش گاوس ریاضیدان آلمانی در سال ۱۸۰۰ میلادی ثابت کرده که برای هر عدد طبیعی m>۲ عدد اول p
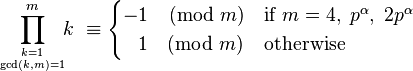
در اینجا  عددی صحیح و مثبت است.
عددی صحیح و مثبت است.
کشف و محاسبه[ویرایش]
بزرگترین عدد اول کشف شده برابر دو به توان 57میلیون و 885هزار و 161منهای یک است.این عدد یک عدد مرسن است. عدد مرسن عددی است که برابر ۲ به توان n منهای یک است. گروه محاسباتی سراوان دیتا که یک گروه محاسباتی ارانی میباشد که در زمینههای مختلف محاسباتی از جمله اعداد اول فعالیت میکند اعداد بسیاری را کشف و محاسبه کرده از جمله تمام اعداد اول یک تا دویست میلیون
جایزهها برای پیدا کردن اعداد اول[ویرایش]
موسسه Electronic Frontier Foundation جایزهای به مبلغ صدهزار دلار برای اولین کسی که یک عدد اول با حداقل 10 میلیون رقم پیدا کند در نظر گرفته است.همچنین مبلغ 150 هزار دلار برای کسی که یک عدد اول با 100 میلیون رقم و 250 هزار دلار برای 1 میلیارد رقم در نظر گرفته شده است.این موسسه ممکن است مبلغ 100 هزار دلار برای دپارتمان ریاضی دانشگاه UCLA که موفق به کشف یک عدد اول 13 میلیون رقمی شدند پرداخت کند.
الگوهای توزیع اعداد اول[ویرایش]
یکی از مسائل مورد توجه ریاضیدانان، چگونگی توزیع و ترتیب قرارگرفتن اعداد اول درون رشته اعداد طبیعی است. این چگونگی دارای الگوهایی است که یکی از آنها به «الگوی پیشرفت عددی» معروف است.
مثلاً اگر به عدد ۵ که عددی اول است، ۶ واحد اضافه کنیم به ۱۱ و اگر به ۱۱، ۶ واحد اضافه کنیم به ۱۷ و اگر دوباره اضافه کنیم، به ۲۳ و ۲۹ میرسیم که همگی اعدادی اولند. اما با اضافه کردن ۶ واحد دیگر به ۳۵ میرسیم که عددی اول نیست و الگو متوقف میگردد.
مسئله مورد توجه اینست که در هر الگوی پیشرفت چند عدد اول پیش از رسیدن به اولین عدد غیر اول، بدست میآیند؟ طولانیترین رشتهای که تاکنون بدست آمده، ۲۲ عدد اول را شامل است. اولین عدد اول این رشته ۱۱۴۱۰۳۳۷۸۵۰۵۵۳ بوده که اگر عدد ۴۶۰۹۰۹۸۶۹۴۲۰۰ به آن اضافه شود عدد اول بعدی بوجود میآید و میتوان ۲۲ بار عدد مذکور را به اعداد اول مرحله قبل افزود و عدد اولی جدید بدست آورد. دو ریاضیدان اثبات کردهاند برای هر رشته از اعداد اول میتوان به یک رشته عددی رسید.
قانون گاوس
قانون گاوس در فیزیک با نام قضیه شار گاوس هم شناخته شده که قانونی است در ارتباط با توزیع بار الکتریکی که پیامد آن میدان الکتریکی است قانون گاوس توضیح میدهد که:
شار الکتریکی کل در هر سطح بستهای برابر است با بار کل احاطه شده توسط آن سطح
این قانون توسط کارل فردریک گاوس در سال ۱۸۳۵ فرمولبندی شد ولی در سال ۱۸۶۷ منتشر گشت. این قانون یکی از چهار معادله ماکسول است که اساس الکترودینامیک کلاسیک را تشکیل میدهند، سه تای دیگر عبارت اند از:قانون گاوس برای مغناطیس، قانون القاء فارادی، و قانون آمپر به تصحیح ماکسول. از قانون گاوس میتوان برای استخراج قانون کولن استفاده کرد و بالعکس. با اعمال مناسب قضیه واگرایی به قانون کولن , قانون گاوس نتیجه میشود.
قانون گاوس معمولاً به فرم انتگرالی زیر بیان میشود:
که در آن سمت چپ تساوی انتگرال سطحی است که نشر شار الکتریکی را از سطح بسته S بیان میکند، و سمت راست تساوی بار کل محصور شده در همان سطح S تقسیم بر ثابت الکتریکی است.
قانون گاوس همچنین فرم دیفرانسیلی به شکل زیر دارد:
که در آن E · ∇ دیورژانس میدان الکتریکی است و ρ چگالی بار است. فرم انتگرالی و دیفرانسیلی با قضیه دیورژانس به هم مرتبط میشوند. هر یک از این اشکال دیفرانسیلی و انتگرالی را میتوان به دو فرم دیگر بیان کرد: از دید ارتباط بین میدان الکتریکی E و بار الکتریکی کل، یا از دید جابجایی میدان الکتریکی D و بار الکتریکی آزاد. قانون گاوس تشابه ریاضیاتی زیادی با تعدادی از قوانین فیزیک در سایر زمینهها دارد، مثل قانون گاوس در مغناطیس و قانون گاوس در جاذبه. در واقع، هر «قانون مربع معکوس» را میتوان به شکل مشابهی با قانون گاوس فرمولبندی کرد: برای مثال، خود قانون گاوس خود اساساً برابر با مربع معکوس قانون کولن است، و قانون گاوس برای جاذبه اساساً با مربع معکوس قانون جاذبه نیوتون برابر است.
محتویات
[نهفتن]
از دیدگاه بار کل[ویرایش]
فرم انتگرالی[ویرایش]
برای حجم V با سطح S، قانون گاوس بیان میکند که
که ΦE,S شار الکتریکی در S است، Q بار کل در حجم V است، و ε۰ ثابت الکتریکی است. شار الکتریکی از انتگرال گیری روی سطح Sبدست میآید:
که E میدان الکتریکی است و dA نشانگر برداری از المان بی نهایت کوچک سطح میباشد و (.) به عنوان ضرب داخلی برداری به کار میرود.
به کارگیری فرم انتگرالی[ویرایش]
اگر میدان الکتریکی همه جا معلوم باشد، قانون گاوس کار را خیلی راحتتر میکند، در اصل، برای یافتن توزیع بار الکتریکی: باری را که در هر ناحیه داده شده میتواند با یکپارچگی میدان الکتریکی و یافتن شار استنباط کرد. با این حال، بیشتر اوقات، این مشکل معکوسی است که باید حل شود: یعنی توزیع بار الکتریکی معلوم است، و میدان الکتریکی باید محاسبه شود. این خیلی مشکل تر است، زمانی که شما شار کل عبوری از سطح را میدانید، که این تقریباً هیچ اطلاعاتی در مورد میدان الکتریکی نمیدهد، که خود میتواند از روی الگوی پیچیدهای خودسرانه وارد و خارج سطح شود.
فرم دیفرانسیلی[ویرایش]
شکل دیفرانسیلی، قانون گاوس بیان میدارد که:
که · ∇نشان دهنده واگرایی یا همان دیورژانس، E میدان الکتریکی، و ρ چگالی بار کل است، و ε۰ ثابت الکتریکی است. این معادله از لحاظ ریاضی بنا به قضیه دیورژانس با فرم انتگرالی معادل است.
هم ارزی فرم دیفرانسیلی و انتگرالی[ویرایش]
فرمهای دیفرانسیلی و انتگرالی از دیدگاه ریاضی معادل اند، از طریق قضیه دیورژانس. به بیان دقیق تر: فرم انتگرالی قانون گاوس به این صورت است که:
برای هر سطح بسته S که بار Q را در بر میگیرد. با قضیه دیورژانس، این معادله برابر است با:
برای هر حجم V که بار Q را در بر میگیرد. با توجه به ارتباط بین بار الکتریکی و چگالی بار، این تساوی معادل است با:
برای هر حجم V. برای این که این معادله به طور همزمان برای هر حجم ممکن V برقرار باشد، این شرط لازم و کافی است که معادلات زیر انتگرال برابر باشند. بنابراین، این تساوی معادل است با
پس معادلات دیفرانسیل و انتگرال معادل هستند.
از دیدگاه بار آزاد[ویرایش]
بار آزاد در مقابل بار مقید[ویرایش]
بار الکتریکی که در سادهترین موقعیتهای کتاب درسی بیان میشود در میان بار الکتریکی آزاد طبقه بندی میشود، برای مثال، باری که در الکترواستاتیک جابجا میشود، یا باری که روی صفحههای خازن ذخیره میشوند. در عوض بار مقید فقط در مورد چارچوب دی الکتریکبیان میشود و موادی که قابلیت قطبی شدن دارند.(تمام مواد تا حدی قابلیت قطبش دارند.) زمانی که موادی این چنین در یک میدان الکتریکی خارجی قرار میگیرند، الکترونها در قید اتمهای خود میمانند، اما در پاسخ به میدان الکتریکی یک تغییر فاصله میکروسکوپی با اتم خود میدهند، بنابر این الکترونهای یک سمت بیشتر از سمت دیگر اتم میشود. همه این جابجاییهای میکروسکوپیک جمع میشوند تا یک شبکه توزیع بار را تشکیل دهند، و این به منزله وجود بار مقید است. همه بارها از دیدگاه میکروسکوپیک اساساً یکسان هستند، اغلب دلایل عملی برای تمایز بین بار مقید و بار آزاد وجود دارد. یکی از دلایل اساس قانون گاوس است، که از لحاظE، در اکثر موارد در معادلات برای محاسبات و استفاده از D باید بار را به صورت بار آزاد در نظر بگیریم.
فرم انتگرالی[ویرایش]
این فرمولبندی از قانون گاوس بیان میدارد که، برای هر حجمV در فضا، با سطح S، رابطه زیر برقرار است:
که ΦD,S شار جابجایی میدان الکتریکی D از سطح S، و 'Qfree بار آزادی است که در حجم V قرار دارد. شار ΦD,S مشابه شار میدان الکتریکی ΦE,S که شار E از سطح S است تعریف شده. به ویژه که آن از انتگرال سطح بدست میآید
فرم دیفرانسیلی[ویرایش]
فرم دیفرانسیلی قانون گاوس، که فقط شامل بارهای آزاد میشود، بیان میدارد:
که D · ∇ دیورژانس جابجایی میدان الکتریکی است، و ρfree چگالی بار آزاد میباشد. فرم دیفرانسیلی و فرم انتگرالی از لحاظ ریاضیاتی معادل اند.
بیان هم ارزی بار کل و بار آزاد [ویرایش]
در مواد خطی[ویرایش]
در مواد همگن، ایزوتروپیک، ناپاشنده خطی یک ارتباط ساده و زیبا بین E و D هست:
که ε ضریب گذر دهی الکتریکی مادهاست. تحت این شرایط هنوز یک جفت از فرمولهای قانون گاوس باقی است:
ارتباط با قانون کولن[ویرایش]
استخراج قانون گاوس از قانون کولن[ویرایش]
قانون گاوس میتواند از قانون کولن استخراج شود، قانون کولن بیان میدارد که میدان الکتریکی حاصل از بار ثابت است:
که:er بردار یکه شعاعی است، r شعاع است، :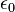 هم ثابت الکتریکی است، q بار ذرهاست، که فرض شده در مبدا قرار دارد.
هم ثابت الکتریکی است، q بار ذرهاست، که فرض شده در مبدا قرار دارد.
با استفاده از این بیان قانون کولن، ما میدان کل را در فاصله r با استفاده از انتگرال گیری برای جمع تمام میدانها در r از بارهای بی نهایت خورد در فضای s را داریم:
اگر ما از هر دو طرف تساوی دیورژانس بر حسب r بگیریم داریم
که (δ(s تابع دلتای دیراک است، حاصل به شکل زیر بدست میدهد:
با استفاده از خاصیت غربالگری تابع دلتای دیراک میرسیم به:
که همان فرم دیفرانسیلی قانون گاوس هست، درست همان طور که انتظار داشتیم.
استخراج قانون کولن از قانون گاوس[ویرایش]
به صرف گفتار، قانون کولن را نمیتوان از قانون گاوس استخراج کرد چون قانون گاوس هیچ اطلاعاتی در مورد کرل یا تاو E نمیدهد. با این وجود، قانون کولن میتواند از قانون گاوس اثبات شود، بعلاوه، میدان الکتریکی حاصل از بار نقطهای به شکل کروی متقارن است(این فرض مثل خود قانون کولن است، که وقتی بار ثابت است دقیقاً صحت دارد، و وقتی بار در حرکت باشد تقریباً درست است).
قرار دادن S در فرم انتگرالی قانون گاوس سطح کرهای به دست میدهد به شعاع r، که بار نقطهای Q در مرکز قرار دارد:
با فرض تقارن کروی، حاصل انتگرال مقدار ثابتی میشود که میتوان از زیر انتگرال خارج کرد، و نتیجه میدهد:
که  بردار یکه شعاعی است که سمت بار نقطهای را که در فاصله r هست نشان میدهد، دوباره با استفاده از تقارن کروی، E در راستای شعاعی را به دست میدهد:
بردار یکه شعاعی است که سمت بار نقطهای را که در فاصله r هست نشان میدهد، دوباره با استفاده از تقارن کروی، E در راستای شعاعی را به دست میدهد:
که اساساً معادل قانون کولن میباشد.
 |
دید کلی
تغییراتی که در واکنشی بر روی مواد واکنش دهنده صورت میگیرد، بطور کلی به دو نوع تغییر فیزیکی و تغییر شیمیایی ، تقسیم میشوند. در تغییر فیزیکی ، فقط حالت فیزیکی ماده تغییر مییابد. یعنی ساختار ذرههای تشکیل دهنده ماده تغییر نمیکند. بنابراین تغییر کلیه حالات ماده نظیر ذوب و انجماد و تبخیر و تصعید و غیره همچنین انحلال نمک ها و بازها در آب ، تغییر فیزیکی محسوب میشوند.
لیکن در تغییر شیمیایی ، در واقع اتصال اتمها به یکدیگر در واکنش دهنده ها دستخوش تغییر میشود و همچنین آرایش الکترونی اتمها نیز تغییر مییابد. البته باید توجه داشت که در جریان یک واکنش شیمیایی ، اتمها نه بوجود میآیند و نه از بین میروند و تنها شامل ترکیب ، تجزیه یا بازآرایی اتمهاست.
واکنش شیمیایی در واقع توصیفی برای یک تغییر شیمیایی است. واکنشهای شیمیایی ممکن است با آزاد کردن انرژی بصورت گرما ، نور یا صوت همراه باشند و تولید یک گاز ، تشکیل یک رسوب یا تغییر رنگ در پی داشته باشند.
روی دادن تغییر فیزیکی و تغییر شیمیایی بطور متوالی
البته مواردی وجود دارد که هر دو تغییر فیزیکی و شیمیایی بر روی یک پدیده ، بطور متوالی اتفاق میافتند. برای مثال ، با حرارت دادن تکه ای قند در لوله آزمایش ، ابتدا قند ذوب میشود که یک پدیده فیزیکی است. سپس به رنگ قهوه ای در میآید که نشاندهنده شروع تبدیل قند به کربن و یک پدیده شیمیایی است. در ادامه ، مقداری بخار آب به بالای لوله میرسد که نشانه تجزیه قند و ادامه پدیده شیمیایی قبل است.
پس قطرههای آب روی دیواره لوله آزمایش پدیدار میشود که نشاندهنده میعان بخار آب آزاد شده و یک پدیده فیزیکی است. در پایان ، در داخل لوله ، مادهای سیاهرنگ ، بیمزه و نامحلول در آب (برخلاف قند اولیه) باقی میماند که این ماده جدید ، زغال است و با توجه به تغییر رنگ ، مزه و حلالیت آن در آب ، نشاندهنده وقوع یک پدیده شیمیایی است.
انرژی شیمیایی
هر نوع پیوندی میان اتمهای مختلف سازنده مولکول یک جسم ، نوعی انرژی بنام در "انرژی شیمیایی" دارد که مقدار آن به نوع اتمها و نحوه قرار گرفتن آنها در مولکول بستگی دارد. در یک واکنش شیمیایی ، در واقع اتصال اتمها به یکدیگر در واکنشها دستخوش تغییر میشود و در نتیجه انرژی شیمیایی فراوردههای واکنش با انرژی شیمیایی واکنشدهندهها تفاوت پیدا میکند.
به عنوان مثال ، واکنش گاز کلر با گاز هیدروژن را در نظر بگیریم. گاز کلر از مولکولهای دو اتمی Cl2 و گاز هیدروژن از مولکولهای دو اتمی H2 تشکیل شدهاند. فراورده واکنش ، کلرید هیدروژن HCl خواهد بود که در مقایسه با واکنشدهنده با پیوندهای کاملا متفاوتی دارد و از این رو انرژی شیمیایی آنها متفاوت است.
اکنون این پرسش مطرح میشود که با توجه به متفاوت بودن انرژی شیمیایی فراوردهها و واکنشدهندهها با در نظر گرفتن "قانون پایستگی انرژی" این اختلاف انرژی به چه صورت ظاهر میشود؟
تغییر گرماگیر و تغییر گرماده
مطابق قانون پایستگی انرژی ، در هر واکنش ، باید انرژی کل ثابت بماند. بنابراین در واکنشها ، اختلاف انرژی میان فراوردهها و واکنشدهندهها به صورت گرما ظاهر میشود. از این رو ، واکنشهایی نظیر واکنشهای سوختن متان و با تشکیل کلرید هیدروژن که در آنها ، سطح انرژی فراوردههای واکنش از مواد واکنشدهنده پایینتر باشد، بعلت تولید انرژی گرمایی گرماده میگوییم و در مقابل ، واکنشهایی که در آنها سطح انرژی شیمیایی فراوردهها بیشتر از واکنشدهندهها باشد، واکنشهای گرماگیر نامیده میشوند و برای انجام چنین واکنشی باید مقداری گرما به اجزای واکنشدهنده داده شود، مانند تجزیه کردنکلرید آمونیوم جامد که با گرم کردن ، به دو گاز آمونیاک و کلرید هیدروژن تبدیل میشود.
بنابراین در اندازه گیری و محاسبه انرژی واکنشهای شیمیایی ، چیزی که همیشه محسوس و قابل اندازهگیری است، تفاوت محتوای انرژی یا بعبارتی سطح انرژی مواد اولیه و محصولات عمل است که معمولا به تغییر محتوای گرمایی ، تغییر آنتالپی گفته میشود و با ΔH نمایش میدهند و در یک واکنش گرماده خواهیم داشت:
به این ترتیب تغییر آنتالپی ΔH در یک واکنش انرژیده ، منفی است.
در یک واکنش گرماگیر خواهیم داشت:
 |
پس تغییر آنتالپی ، ΔH در یک واکنش انرژیگیر ، مثبت است.
واکنشهای شیمیایی برگشت پذیر و برگشت ناپذیر
واکنشهای برگشت ناپذیر
در این قبیل واکنشها ، محصولات واکنش بر هم اثر شیمیایی ندارند. به همین دلیل واکنش فقط در جهت رفت انجام میگیرد و تا مصرف شدن کامل واکنشدهنده پیش میرود. مثلا اگر تکهای نوار منیزیم را در ظرف محتوی HClوارد کنیم، واکنش شدیدی میان منیزیم و اسید رخ میدهد و فلز بتدریج در اسید ، حل و ناپدید میشود و همزمان با ناپدید شدن فلز ، حبابهای گاز هیدروژن درون اسید به چشم میخورند که از ظرف خارج میشوند.
بنابراین این واکنش یکطرفه است و فقط در جهت رفت پیش میرود. یعنی اگر مقداری گاز هیدروژن را در محلول کلرید وارد کنیم، هیچگونه واکنشی انجام نمیگیرد.
علاوه بر واکنش فوق ، سوختن انواع سوختها مانند بنزین ، نفت ، گاز طبیعی و... در مجاورت هوا ، محکم شدن تدریجی سیمان ، پختن تخم مرغ ، مچاله شدن نایلون در برابر شعله ، نمونههایی از واکنشهای برگشت ناپذیرند.
واکنشهای برگشت پذیر
این واکنشها در شرایط مناسب در هر دو جهت رفت و برگشت پیش میروند، مثلا اگر بخار آب را از روی گرد آهن داغ عبور دهند، اکسید آهن همراه با گاز هیدروژن پدید میآید.
و اگر گاز هیدروژن را بر اکسید آهن ( Fe3O4 ) عبور دهند، آهن و بخار آب تولید میشود. واکنش برگشت:
واکنش رفت و برگشت در مجموع یک واکنش برگشت پذیر را تشکیل میدهند و در نتیجه ، واکنش اثر بخار آب بر آهن داغ ، برگشت پذیر است. در زندگی روزانه با موارد زیادی از واکنشهای برگشت پذیر برخورد میکنیم، مانند شارژ مجدد باطری اتومبیل. مواد شیمیایی موجود در باطری خودرو هنگام تولید جریان برق بتدریج مصرف شده و به مواد دیگری تبدیل میشود. با شارژ مجدد باطری ، واکنشهای برگشت انجام میگیرند و مواد اولیه پدید میآیند.
 |
مثالهایی از فرایندهای شیمیایی
همانظور که قبلا ذکر شد، در تغییر شیمیایی ، ماهیت شیمیایی مواد تغییر مییابد و فراوردههای جدید با خواص متفاوت از مواد اولیه تولید میشود. بنابراین پدیده های زیر نمونه هایی از تغییرهای شیمیایی محسوب میشوند:
- سوختن انواع سوختها. مانند بنزین ، نفت ، گاز طبیعی و... در مجاورت هوا
- زنگ زدن فلزات
- گوارش غذا
- رسیدن میوه
- پختن غذا
- فساد مواد
- محکم شدن تدریجی سیمان.
- انحلال آمونیاک در آب. زیرا در اثر انحلال ، قسمتی از مولکولهای آمونیاک با مولکولهای آب ترکیب شده و ماده جدیدی به نام هیدروکسیدآمونیوم تولید مینمایند. بهمین دلیل که واکنش شیمیایی بین حلال و حل شونده رخ میدهد، حل شدن بیشتر جنبه شیمیایی دارد.
- لخته شدن مواد کلوئیدی. در اثر لخته شدن ، پیوندهای جدیدی تشکیل میگردد که باعث تجمع مولکولهای یک محلول کلوئیدی میشود.
اعداد حسابی
اعداد حسابی همان اعداد طبیعی هستند که صفر هم به آنها اضافه شده است. به عبارت دیگر به مجموعهی اعداد زیر ، اعداد صحیح یا اعداد درست گویند و آن را با Z نمایش میدهند:
{ ... , 3 , 2 , 1 , 0 , 1- , 2- , 3- , ...} = Z
درواقع اعداد صحیح شامل اعداد طبیعی مثبت و اعداد طبیعی منفی و عدد صفر است. این اعداد همانند اعداد طبیعی جزء مجموعه های شمارش پذیر نامتناهی است. شاخه ای از ریاضیات که به مطالعه در مورد ویژگیهای اعداد صحیح می پردازدنظریه اعداد نام دارد.
صحیح همانند اعداد طبیعی نسبت به اعمال جمع و ضرب بسته است،یعنی جمع و ضرب هر دو عدد صحیح، یک عدد صحیح است. و چون اعداد صحیح شامل اعداد منفی و صفر می باشند بنابراین بر خلاف اعداد طبیعی نسبت به عمل تفریق نیز بسته اند.ولی چون حاصل تقسیم دو عدد صحیح بر هم ممکن است عددی صحیح نباشد،پس نمیتواند نسبت به عمل تقسیم بسته باشد.
اعداد طبیعی
اعداد طبیعی، اعدادی هستند که برای شمردن به کار میروند. مجموعه اعداد طبیعی {... ,۳ ,۲ ,۱} است.
در این مجموعه عدد صفر وجود ندارد و با اضافه کردن آن، مجموعه اعداد حسابی به وجود میآید. این مجموعه یک مجموعه نامتناهی است.
در ریاضیات، مجموعه اعداد طبیعی را با نماد N نمایش میدهند. این حرف از آغاز واژه انگلیسی Natural، به معنای طبیعی، گرفته شده است.
اعداد گنگ اعداد اصم
اعداد گنگ، یا اعداد اصم، اعدادی حقیقی هستند که گویا نباشند، یعنی نتوان آنها را به صورت کسری که صورت و مخرجش عدد صحیح باشند نوشت. مجموعه اعداد گنگ مجموعهای ناشمارا است ولي میتوان اعداد گنگ را روي محور اعداد نمايش داد كار بسيار ساده ايي است كافي است هندسه را در رياضيات مورد استفاده قرار دهيم . امتحان كنيدميتوان از رابطه فيثاغورث استفاده كرد.
اعداد اول
اعداد اول اعدادی طبیعی هستند که بر هیچ عددی بجز خودشان و عدد ۱ بخشپذیر نباشند. تنها استثنا عدد ۱ است که جزو این اعداد قرار نمیگیرد. اگرعددی طبیعی وبزرگتر از ۱ اول نباشد مرکب است.
عدد یکان اعداد اول بزرگتر از ۱۰ فقط ممکن است اعداد ۱، ۳، ۷، ۹ باشد.
اعداد اول جزو یکی از معماهای ریاضی باقیمانده است و هنوز کسی به فرمولی برای آنها به دست نیاورده است.
سری اعداد اول به این صورت شروع میشود: ۲، ۳، ۵، ۷، ۱۱، ۱۳، ۱۷، ۱۹ ...
قضیه ۱: تعداد اعداد اول بینهایت است.
برهان: حکم را به روشی که منسوب به اقلیدس است اثبات میکنیم: فرض کنید تعداد اعداد اول متناهی و تعداد آنها n تا باشد. حال عدد M را که برابر حاصلضرب این اعداد به علاوه ۱ را در نظر بگیرید. این عدد مقسومعلیهی غیر از آن n عدد دارد که با فرض در تناقض است.
قضیه ۲ (قضیه اساسی حساب): هر عدد طبیعی بزرگتر از ۱ را به شکل حاصلضرب اعدادی اول نوشت.
قضیه ۳ (قضیه چپیشف):اگر n عددی طبیعی و بزرگتر از ۳ باشد، حتما" بین n و ۲n عدد اولی وجود دارد. قضيه ۴ هر عدد زوج را میتوان بصورت جمع سه عدد اول نوشت.
قضيه ۵ هر عدد فرد (شامل اعداد اول) را میتوان به صورت جمع سه عدد اول نوشت (اثبات بر پايه قضيه ۴)
قضيه 6-هر عدد فرد را میتوان به صورت دو برابر يك عدد اول بعلاوه يك عدد اول ديگر نوشت.
خواص اعداد اول
1- هر عدد اول برابر است با 6n+1 يا 6n-1 كه n يك عدد صحيح است.
2-مجذور هر عدد اول برابر است با 24n+1.
3-تفاضل مجذورهاي دو عدد اول مضربي از 24 است.
4-حاصلضرب هر دو عدد اول بجز 2و3 مضربي از 6 بعلاوه يا منهاي يك است.
توان چهارم هر عدد اول بجز 2و3 مضربي از 240 بعلاوه يك است.
بزرگترین عدد اول کشف شده برابر دو به توان ۳۰ميليون و ۴۰۲هزار و ۴۵۷منهاي يك است.این عدد یک عدد مرسن است. عدد مرسن عددی است که برابر 2 به توان n منهای یک است.
لازم به ذكر است كه تعداد 3000 عدد اول در سايت مگاسندرwww.megasender.org وجود دارد و افرادي كه مايل به دريافت بيشتر اين اعداد هستند مي توانند با سايت مذكور تماس گرفته و تعداد بيشتري از آنها را بر روي لوح فشرده دريافت نمايند و طراحان اين سايت خودشان اين اعداد را محاسبه نموده اند.
اعدد جبری
اعداد جبری در ریاضیات اعدادی هستند که جواب معادلهای به شکل زیر باشند:
anxn + an−1xn−1 + ··· + a1x + a0 = 0ضریبهای a0 تا an در این معادله چند جملهای اعداد گویا هستند.
تمام اعداد گویا اعداد جبری هم هستند. بعضی از اعداد حقیقی عدد جبری نیستند. عددی که جبری نباشد عدد متعالی (یا غیرجبری) نامیده میشود.
اعداد گویا
اعداد گویا1 حاصل تقسیم دو عدد صحیح بر یکدیگرست، به شرطی که عدد دوّم (مقسوم علیه) صفر نباشد. به بیان دیگر، هر عدد گویا را میتوان به شکل a/b یا آ بيم نوشت (که a و b اعداد صحیحاند).
در ریاضیات، مجموعه اعداد گویا را، عموماً، با Q نمایش میدهند. به عنوان مجموعهای شمارا (یا قابل شمارش)، ولی نامتناهی، مجموعهٔ اعداد گویا، خود، زیرمجموعهایست چگال (dense) از مجموعهٔ بزرگتر و عمومیتر اعداد حقیقی.
اعداد صحیح
مجموعهٔ اعداد صحیح به اجتماع مجموعهٔ اعداد طبیعی، قرینهٔ اعداد طبیعی ، و {0} (مجموعه ای که تنها عدد صفر عضو آن است) گفته می*شود. در ریاضیّات، معمولاً این مجموعه را با Z یا (ابتدای کلمه آلمانی Zahlen به معنی اعداد) نشان می*دهند. همانند مجموعهٔ اعداد طبیعی، مجموعهٔ اعداد صحیح نیز یک مجموعهٔ شمارای نامتناهی*ست.
شاخه*ای از ریاضیّات که به مطالعهٔ اعداد صحیح می*پردازد، نظریهٔ اعداد نام دارد.
خواص جبری
همانند اعداد طبیعی، نیز نسبت به دو عمل جمع و ضرب بسته است. این بدان معناست که حاصل جمع و حاصل ضرب دو عدد صحیح، خود، یک عدد صحیح است. بر خلاف مجموعهٔ اعداد طبیعی، از آنجا که اعداد صحيح منفی، و به ویژه، عدد صفر هم به تعلق دارند، این مجموعه، نسبت به عمل تفریق نیز بسته است. اما تحت عمل تقسیم بسته نیست، زیرا خارج قسمت تقسیم دو عدد صحیح، لزوما عددی صحیح نخواهد بود.
برخی از خواصّ اساسی مربوط به عملیّات جمع و ضرب در جدول زیر گنجانیده شده است (در اینجا b ،a، و c اعداد صحیح دل*خواه هستند:)
جمع ضرب
بسته بودن:
a + b یک عدد صحیح است a × b یک عدد صحیح است
شرکت پذیری:
a + (b + c) = (a + b) + c a × (b × c) = (a × b) × c
تعویض پذیری:
a + b = b + a a × b = b × a
وجود یک عنصر واحد:
a + 0 = a a × 1 = a
وجود یک عنصر عکس:
a + (−a) = 0
توزیع پذیری:
a × (b + c) = (a × b) + (a × c)
نداشتن مقسوم علیه*های صفر:
اگر ab = 0، آنگاه a = 0 یا b = 0
مطابق جدول بالا، خواصّ بسته بودن، شرکت پذیری و جابه جایی (یا تعویض پذیری) نسبت به هر دو عمل ضرب و جمع، وجود عضو همانی (واحد، یا یکّه) نسبت به جمع و ضرب، وجود عضو مع*** فقط نسبت به عمل جمع، و خاصیّت توزیع پذیری ضرب نسبت به جمع از اهمیت برخوردارند.
اعداد مرکب
عدد مرکب عددی طبیعی بجز یک است که اول نباشد.
- پانزده عدد مرکب اول عبارتاند از:
۴, ۶, ۸, ۹, ۱۰, ۱۲, ۱۴, ۱۵, ۱۶, ۱۸, ۲۰, ۲۱, ۲۲, ۲۴ و ۲۵
- قانون برای تمام اعداد مرکب وبزرگ تر از ۵(فقط ۴ از این قاعده پیروی نمیکند) صدق میکند.
اعداد حقیقی
مجموعه اعداد حقیقی که با R نمایش داده می شود و شامل کلیه ی اعداد صحیح,گویا,طبیعی و حسابی و همچنین شامل R-Q است که اعدادگنگ یا اصم می باشد می شود